3.2 พันธะไอออนิก
สารที่เกิดจากธาตุโลหะกับธาตุอโลหะ มีสมบัติบางประการคล้ายกัน และสารเหล่านี้มีการยึดเหนี่ยวระหว่างอนุภาคที่เหมือนกัน3.2.1 การเกิดพันธะไอออนิก
ธาตุโลหะมีพลังงานไอออไนเซชันต่ำจึงเสียอิเล็กตรอนเกิดเป็นไอออนบวกได้ง่ายส่วนธาตุอโลหะมีค่าสัมพรรคภาพอิเล็กตรอนสูง จึงรับอิเล็กตรอนเกิดเป็นไอออนลบ ไอออนบวกและไอออนลบมีประจุไฟฟ้าต่างกันจึงยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้า เรียกการยึดเหนี่ยวนี้ว่าพันธะไอออนิกและสารที่เกิดขึ้นจากพันธะไอออนิกว่าสารประกอบไอออนิกชื่อสารประกอบไอออนิกที่เกิดขึ้นส่วนใหญ่เป็นไปตามกฎออกเตต
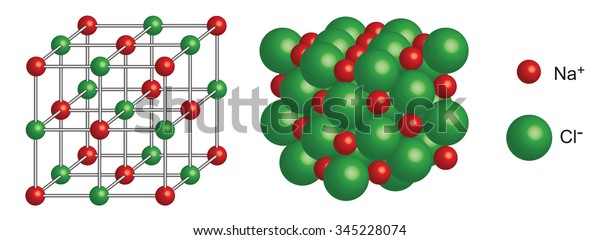
สารประกอบไอออนิกในสถานะของแข็งอยู่ในรูปของผลึกที่มีไอออนบวกและไอออนลบยึดเหนี่ยวกันด้วยพันธะไอออนิกอย่างต่อเนื่องกันไปทั้ง 3 มิติเป็นโครงผลึก และไม่อยู่ในรูปโมเลกุล
3.2.2 สูตรเคมีและชื่อของสารประกอบไอออนิก
สารประกอบไอออนิกประกอบด้วยไอออนบวกและไอออนลบที่มีประจุต่างกัน ซึ่งมีผลต่ออัตราส่วนการรวมของไอออนและสูตรของสารประกอบไอออนิกด้วยประจุของไอออน 5 มูลหลักเป็นบวกตามจำนวนและการที่ให้หรือเป็นโรคตามจำนวนอิเล็กตรอนที่รับเพื่อทำให้มีการจัดเรียงอิเล็กตรอนของไอออนเป็นไปตามกฎออกเตต
การที่โครงสร้างของสารประกอบไอออนิกที่มีไอออนบวกและไอออนลบยึดเหนี่ยวกันอย่างต่อเนื่องกันไปทั้ง 3 มิติเป็นโครงผลึกไม่สามารถแยกเป็นโมเลกุลได้ดังนั้นจึงใช้สูตรเอมพิริคัล แสดงอัตราส่วนอย่างต่ำของจำนวนไอออนที่เป็นองค์ประกอบซึ่งทำให้ได้ผลรวมประจุเป็นศูนย์
การเขียนสูตรสารประกอบไอออนิกจะเขียนสัญลักษณ์ของธาตุที่เป็นไอออนบวกไว้ข้างหน้าตามด้วยไอออนลบและแสดงอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบโดยเขียนตัวเลขอารบิกให้ทายไอออนทั้งนี้กรณีที่จำนวนไอออนเป็นหนึ่งไม่ต้องเขียนเช่นสารประกอบไอออนิกที่เกิดจากแคลเซียมไอออนกับฟลูออไรด์ไอออนมีอัตราส่วนประจุของ Ca^2+ ต่อ F^- เป็น 2 ต่อ 1 ซึ่งเมื่อทำให้ผลรวมของประจุเป็นศูนย์จะได้อัตราส่วนอย่างต่ำของจำนวน Ca^2+ ต่อ F^- เป็น 1:2 ดังนั้นสูตรสารประกอบเป็น CaF^2
สารประกอบไอออนิกเกิดจากไอออนบวกและไอออนลบดังนั้นการเรียกชื่อสารประกอบไอออนิกจึงจำเป็นต้องสร้างชื่อของไอออนบวกและไอออนลบโดยชื่อของไอออนบวกเรียกตามชื่อถ้าเราลงท้ายด้วยคำว่าไอออนส่วนไอออนลบเรียกตามชื่อธาตุโดยเปลี่ยนท้ายเสียงเป็น i-de
ไอออนที่เป็นกลุ่มอะตอมมีชื่อเรียกเฉพาะโดยกลุ่มอะตอมที่เป็นไอออนบวกลงท้ายด้วย -ium ส่วนกลุ่มอะตอมที่เป็นไอออนลบอาจจะลงท้ายด้วยเสียง -ide -ite -ate
ชื่อสารประกอบไอออนิกได้จากการเรียกชื่อไอออนบวกแล้วตามด้วยชื่อไอออนลบโดยตัดคำว่าไอออนออก ดังตาราง
3.2.3 พลังงานกับการเกิดสารประกอบไอออนิก
ปฏิกิริยาเคมีนอกจากจะเกี่ยวข้องกับการเปลี่ยนแปลงของสารเคมีแล้วส่วนใหญ่ยังเกี่ยวข้องกับการเปลี่ยนแปลงพลังงานอีกด้วยซึ่ง พลังงานการเกิดของสารประกอบ สามารถหาได้จากการทดลองในการทำปฏิกิริยาระหว่างธาตุ เช่นการเกิดสารประกอบโซเดียมคลอไรด์จากโลหะโซเดียมทำปฏิกิริยากับแก๊สคลอรีนเกิดเป็นโซเดียมคลอไรด์มีการคายพลังงาน 412 กิโลจูลต่อโมล
Na(s) + 1/2Cl2(g) ---> NaCl(s) -412kJ/mol
ปฏิกิริยาเคมีเกี่ยวข้องกับการสลายพันธะและการสร้างพันธะ ซึ่งการสลายพันธะ เป็นกระบวนการดูดพลังงาน ในขณะที่การสร้างพันธะเป็นกระบวนการคายพลังงานดังนั้นปฏิกิริยาที่เกิดขึ้นจากการรวมตัวกันของไอออนบวกและไอออนลบเกิดเป็นสารประกอบไอออนิกเป็นปฏิกิริยาคายพลังงานเนื่องจากมีการสร้างพันธะไอออนิก
พลังงานที่เกี่ยวข้องกับการรวมตัวกันของไอออนบวกและไอออนลบในสารประกอบไอออนิกเรียกว่าพลังงานโครงผลึกซึ่งในทางปฏิบัติไม่สามารถทำการทดลองได้โดยนำไอออนบวกและไอออนลบที่บริสุทธิ์มาทำปฏิกิริยากันได้ค่าพลังงานดังกล่าวจึงได้จากการคำนวณโดยอาศัยขั้นตอนการเกิดปฏิกิริยาย่อยๆหลายขั้นตอนตามวัฏจักรบอร์น-ฮาเบอร์ โดยมีสมมติฐานว่าพลังงานรวมในแต่ละขั้นตอนจะเท่ากับพลังงานในการเกิดสารประกอบไอออนิกเช่นการเกิดสารประกอบโซเดียมคลอไรด์ 1 โมล ประกอบด้วยขั้นตอนต่างๆดังนี้
1. การระเหิดของโซเดียม โลหะโซเดียมสถานะของแข็งระเหิดกลายเป็นอะตอมในสถานะแก๊ส ใช้พลังงาน 107 กิโลจูลต่อโมลของโซเดียมอะตอม เรียกพลังงานในขั้นนี้ว่า พลังงานการระเหิด
2. การสลายพันธะของแก๊สคลอรีน โมเลกุลของแก๊สใช้พลังงาน 122 กิโลจูลต่อโมลอะตอมของคลอรีน เรียกพลังงานในขั้นนี้ว่า พลังงานการสลายพันธะ
3. การแตกตัวเป็นไอออนของโซเดียม อะตอมของโซเดียมในสถานะแก๊สเสียอิเล็กตรอนออกไปกลายเป็น ใช้พลังงาน 496 กิโลจูลต่อโมลอะตอมของโซเดียม เรียกพลังงานในขั้นนี้ว่า พลังงานไอออไนเซชัน
4. การเกิดคลอไรด์ไอออน อะตอมของคลอรีนในสถานะแก๊สรับอิเล็กตรอนที่หลุดออกจากอะตอมของโซเดียมกลายเป็น คายพลังงาน 349 กิโลจูลต่อโมลของคลอไรด์ไอออน พลังงานในขั้นนี้เรียกว่า สัมพรรคภาพอิเล็กตรอน
5. การเกิดโซเดียมคลอไรด์ โซเดียมไอออนกับคลอไรด์ไอออนในสถานะแก๊สรวมตัวกันเป็นผลึกโซเดียมคลอไรด์และคายพลังงานออกมา 787 กิโลจูลต่อโมลของโซเดียมคลอไรด์ เรียกพลังงานในขั้นนี้ว่า พลังงานโครงผลึกหรือพลังงานแลตทิซ
3.2.4 สมบัติของสารประกอบไอออนิก
สารประกอบไอออนิกส่วนใหญ่เป็นผลึกที่แข็งเนื่องจากการยึดเหนี่ยวที่แข็งแรงระหว่างไอออนบวกและไอออนลบและผลึกของสารประกอบไอออนิกมีความเปราะ แตกหักได้ง่ายเนื่องจากการเลื่อนตำแหน่งเพียงเล็กน้อยของไอออนเมื่อมีแรงกระทำอาจทำให้ไอออนชนิดเดียวกันลื่นไถลไปอยู่ตำแหน่งตรงกลางจึงเกิดแรงผลักระหว่างกันดังรูป

จากรูปจะสังเกตเห็นได้ว่าพลังงานที่ได้จากขั้นตอนการพลังงานมีค่ามากกว่าพลังงานที่ได้จากขั้นตอนดูดพลังงานจึงทำให้เกิดสารประกอบโซเดียมคลอไรด์เป็นปฏิกิริยาคายพลังงาน
สารประกอบไอออนิกสถานะของแข็งไม่นำไฟฟ้าเนื่องจาก ไอออนที่เป็นองค์ประกอบยึดเหนี่ยวกันอย่างแข็งแรงไม่สามารถเคลื่อนที่ได้แต่เมื่อหลอมเหลวหรือละลายน้ำจะนำไฟฟ้าได้ดีเนื่องจากไอออนที่เป็นองค์ประกอบยึดเหนี่ยวกันอย่างแข็งแรงไม่สามารถเคลื่อนที่ได้ แต่เมื่อหลอมเหลวหรือละลายน้ำจะนำไฟฟ้าได้เนื่องจากไอออนสามารถเคลื่อนที่ได้ สารประกอบไอออนิกมีจุดหลอมเหลวและจุดเดือดสูงส่วนใหญ่ละลายน้ำได้และสารละลายของสารประกอบไอออนิกในน้ำส่วนใหญ่มีสมบัติเป็นเบสหรือกลางโดยสารละลายของสารประกอบออกไซด์มีสมบัติเป็นเบสและสารละลายของสารประกอบคลอไรด์มีสมบัติเป็นกลาง
กระบวนการที่ไอออนบวกและไอออนลบแยกออกจากโครงผลึกเป็นกระบวนการดูดพลังงานที่มีค่าเท่ากับพลังงานและแลตทิซ ดังที่ได้กล่าวมาแล้ว ส่วนกระบวนการที่โมเลกุลของน้ำล้อมรอบไอออนแต่ละชนิดเป็นกระบวนการคายพลังงานที่เรียกว่า พลังงานไฮเดรชัน
ถ้าค่าพลังงานแลตทิซ น้อยกว่าค่าพลังงานไฮเดรชันการละลายจะเป็นกระบวนการคายพลังงานซึ่งจะทำให้อุณหภูมิของสารละลายสูงขึ้นและสารละลายจะละลายได้ดีที่อุณหภูมิต่ำในทางกลับกันถ้าค่าพลังงานแลตทิซมากกว่าค่าพลังงานไฮเดรชันการละลายจะเป็นกระบวนการดูดพลังงานซึ่งจะทำให้อุณหภูมิของสารละลายลดลงและสารจะละลายได้ดีที่อุณหภูมิสูงในกรณีที่มีค่าพลังงานแลตทิซมากกว่าพลังงานไฮเดรชันมากๆ สารอาจจะละลายได้น้อยมากหรือไม่ละลาย
จากที่ทราบแล้วว่าสารประกอบไอออนิกเมื่อละลายน้ำไอออนบวกและไอออนลบจะแยกออกจากกันถ้าการผสมสารละลายของสารประกอบไอออนิกทำให้เกิดตะกอนแสดงว่าไอออนในสารละลายผสมทำปฏิกิริยากันเกิดเป็นสารใหม่ที่ไม่ละลายน้ำ



ไม่มีความคิดเห็น:
แสดงความคิดเห็น